近年來,真實世界研究助力新藥研發(fā)持續(xù)升溫,目前已有10個藥品納入試點,其中3個進入申報注冊的品種中,2個已搶灘登陸,平均上市時間縮短9.5個月。真實世界研究具備從臨床實踐中獲取患者數據,研究、監(jiān)管便利,時間成本低等特性,在中藥、兒藥及罕見病藥三大類藥品研發(fā)領域的應用值得期待。
新藥審評審批提速,“真實世界研究”應運而生
自從?藥品監(jiān)管機構?這樣的組織機構成立后,藥品審評審批速度就一直是其最重要的KPI之一。
受限于人員的數量和能力,藥品審評審批的工作效率無法在短時間內進行大幅提升,只能優(yōu)化工作的方式,即出臺一系列加速審評審批的政策,如優(yōu)先審評、加速批準、快速通道、突破性療法認定、罕見病認證等。
然而,加速審評審批政策的出臺只能優(yōu)化?審評審批?環(huán)節(jié),作為最嚴謹的科學之一,新藥研發(fā)中最耗費時間、精力、財力的環(huán)節(jié)其實是?臨床試驗?,動輒數年的隨機對照試驗(RCT)成為了新藥上市最大的?限速步驟?。
新藥研發(fā)階段引入真實世界研究(RWS)——通過搜集患者電子病歷、電子健康檔案、醫(yī)保支付數據及個人健康檢測數據等與患者健康狀況和/或診療及保健有關的數據,分析得出這些數據與該藥品的使用有關,有潛在的好處/不足,能大大縮短藥品在研發(fā)過程中的人力、物力及時間。
2018年11月,CDE開始組織專家編寫真實世界證據支持藥物研發(fā)與審評的指導原則,解答真實世界數據(RWD)來源、真實世界證據(RWE)支持藥物監(jiān)管決策等問題。
隨后關于“真實世界證據”的政策文件接踵而來,“真實世界證據支持藥物研發(fā)與審評”、“真實世界證據支持兒童藥物研發(fā)與審評”、“用真實數據產生真實世界證據”、“真實世界數據用于醫(yī)療器械臨床評價技術指導原則”等系列文件,串起了國內真實世界研究的發(fā)展歷程。
近年來CDE發(fā)布的“真實世界研究”相關文件
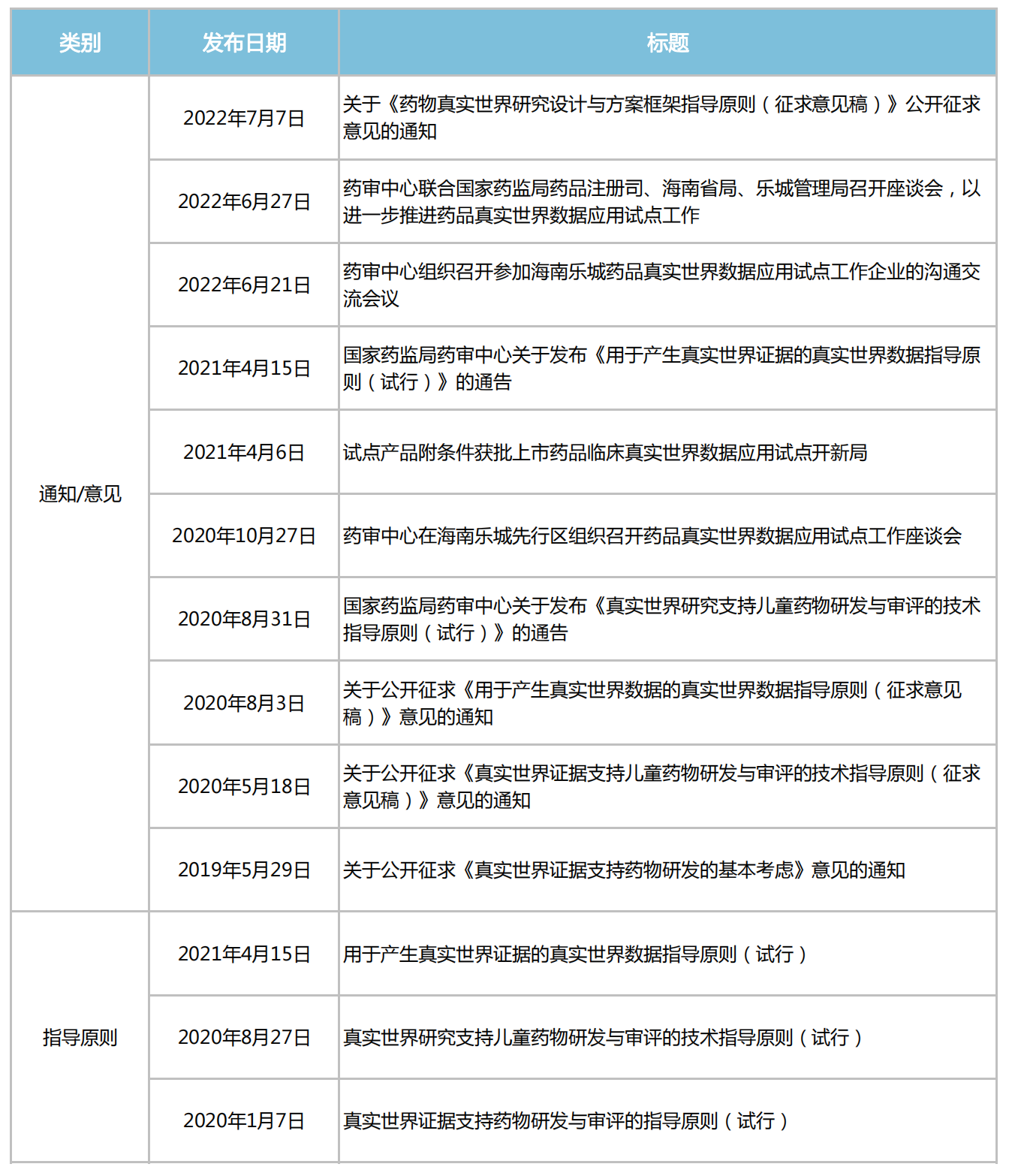
來源:米內網整理
不到兩年:10個品種納入試點,2個搶灘登陸
除上述政策推動外,2020年12月,藥械臨床真實世界數據試點品種啟動會在北京召開,試點產品種類和范圍再次擴大,且首次納入了藥品品種,進一步推動國家藥品審評審批制度改革。
自首次提出藥品應用真實世界研究以來,不到兩年時間就有10個藥品納入試點,其中4個申請人在準備開展真實世界研究;3個正在開展真實世界研究;3個已申報注冊的品種中,普拉替尼膠囊(2021.03)、氟輕松玻璃體植入劑(2022.06)已先后獲批上市。
普拉替尼膠囊適用于既往接受過含鉑化療的轉染重排(RET)基因融合陽性的局部晚期或轉移性非小細胞肺癌成人患者的治療。2020年9月,Blueprint Medicines公司開發(fā)的普拉替尼膠囊在美國獲批,同年10月就進入樂城藥品真實世界研究應用試點,2021年3月獲國家藥監(jiān)局附條件批準上市,為國內首個選擇性RET抑制劑,前后時間不到7個月。
米內網數據顯示,普拉替尼膠囊2022年Q1在中國重點省市公立醫(yī)院終端銷售額為148萬元,已超過2021年Q2~Q4的銷售額總和。在首發(fā)優(yōu)勢及臨床療效的共同驅動下,普拉替尼膠囊的市場潛力正逐步釋放。
近兩年中國重點省市公立醫(yī)院終端普拉替尼銷售趨勢(單位:萬元)
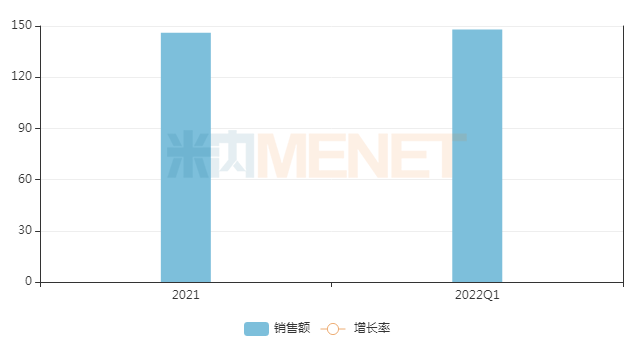
來源:米內網重點省市公立醫(yī)院終端競爭格局
氟輕松玻璃體內植入劑是我國基于境外臨床試驗數據及國內真實世界數據批準的首個進口注冊藥品,適用于治療累及眼后段的慢性非感染性葡萄膜炎,具有眼底局部給藥和長達36個月持續(xù)穩(wěn)定釋放藥物、減少疾病復發(fā)、降低傳統治療副作用大和增加用藥依從性等優(yōu)點。
2020年12月,氟輕松玻璃體內植入劑被納入在海南博鰲樂城真實世界研究應用試點;2022年6月,國家藥監(jiān)局批準該進口品種上市。據生產企業(yè)推算,通過藥品真實世界研究,該藥品商業(yè)化速度加快1年有余,成本不到隨機對照試驗的1/4。
此外,Photocure ASA公司的5-氨基酮戊酸己酯鹽酸鹽膀胱注射液于今年3月納入藥品真實世界研究試點,這是一種輔助膀胱癌診斷或手術的光敏劑類藥物,2021年8月作為臨床急需進口藥品獲批在海南省人民醫(yī)院樂城院區(qū)使用。
全面賦能中藥、兒藥及罕見病研發(fā)
近年來,真實世界研究在國內持續(xù)升溫,目前被廣泛應用到各類新藥研發(fā)領域,不乏多個成功案例。
2013-2017年,石藥集團對其拳頭品種馬來酸左旋氨氯地平片開展了與原研藥在高血壓治療中的RWS,納入患者高達10000余例、覆蓋100多家醫(yī)院。研究表明:前者可降低成本29%,心腦血管事件發(fā)生率相似,不良反應發(fā)生率更低。2019年12月,該藥的臨床數據獲得美國FDA完全認可,且不需額外開展其他臨床試驗,成為中國本土藥企首獲美國FDA完全批準的創(chuàng)新藥,RWS在其成功獲批中發(fā)揮了至關重要的作用。
事實上,自2003年起,石藥集團已在中國推廣銷售馬來酸左旋氨氯地平片,米內網數據顯示,該藥2021年在中國三大終端6大市場(統計范圍詳見本文末)的銷售規(guī)模超過12億元,同比增長15.94%,療效成果顯然得到銷售市場的驗證。
近年來中國三大終端6大市場馬來酸左旋氨氯地平片銷售趨勢(單位:萬元)
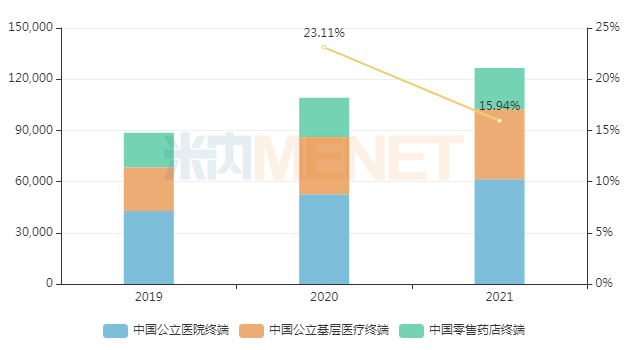
來源:米內網數據庫
不僅是化學藥,RWS還被積極應用于中藥研發(fā)領域,如啟東蓋天力藥業(yè)的一項以槐杞黃顆粒為研究對象的RWS,與同期開展的槐杞黃顆粒相關標準Ⅳ期RCT對比發(fā)現,在標準Ⅳ期RCT中,由于試驗設計的局限性,有一半患者難以接受有效的治療;而在RWS中,接受槐杞黃顆粒治療的患者數量更多。RWS可以不設置空白對照,這對于入組患者而言,無疑起到積極作用。
此外,業(yè)內人士指出,“RWS可以幫助藥企深入探究上市后中藥真實臨床效果,獲得更全面的安全性和有效性信息,還能增加更多的臨床應用價值,取得符合真實臨床情況的成果。”
除助力中藥研發(fā)上市,罕見病藥及兒藥領域更是在RWS上獲益頗豐。
針對罕見病藥,早在2018年10月,CDE基于三家醫(yī)院患者數據的回顧性研究獲得RWE,擴大了貝伐珠單抗(用于治療轉移性癌癥,包括罕見病腦膠質瘤)的適應癥。相關RWS還提供了血管內皮生長因子突變和腦轉移等不同患者亞組中的療效數據,多角度證實了貝伐珠單抗聯合療法的有效性和安全性。
在兒藥方面,產品短缺而導致超說明書用藥的情況十分普遍,利用RWS擴大適應癥,能為兒童人群的臨床合理用藥提供支持。例如,布洛芬注射液通過開展低齡患兒劑量合理性的RWS,補充在中國兒童人群中的臨床證據,獲批用于6個月及以上兒科患者的解熱和鎮(zhèn)痛治療;丙酸氟替卡松吸入氣霧劑通過開展1~4歲兒童用藥安全性監(jiān)測的RWS獲得安全性證據,獲批用于中國哮喘兒童人群范圍至≥1歲兒童適應癥等。
結語
真實世界研究作為新的研究方法,通過在真實醫(yī)療環(huán)境中獲得質量可靠的數據,簡化和避免了傳統臨床試驗遇到的難題,該研究方法將成為今后科研發(fā)展的必然趨勢。真實世界證據的使用無疑是為藥品耗時極長的臨床試驗提供了重要的補充機制,有望成為新藥?加速審評審批?的下一個突破口。
來源:米內網數據庫、CDE官網等
注:米內網《中國三大終端6大市場競爭格局》,統計范圍是:城市公立醫(yī)院和縣級公立醫(yī)院、城市社區(qū)中心和鄉(xiāng)鎮(zhèn)衛(wèi)生院、城市實體藥店和網上藥店,不含民營醫(yī)院、私人診所、村衛(wèi)生室,不含縣鄉(xiāng)村藥店;米內網重點省市公立醫(yī)院化學藥終端競爭格局數據庫是以20+省市,近700家樣本省市公立醫(yī)院的化學藥采購數據為基礎,對化學藥全品類進行連續(xù)監(jiān)測的樣本省市樣本醫(yī)院數據庫;上述銷售額以產品在終端的平均零售價計算。

