近段時間,豪森藥業(yè)產(chǎn)品線迎新進展:大手筆引入重磅雙抗,1類新藥HS-10390片首次申報臨床......米內(nèi)網(wǎng)數(shù)據(jù)顯示,近3年來豪森藥業(yè)達成10余項合作,引進多款差異化新藥,目前有33款新藥(29款1類新藥)處于申報臨床及以上階段,第6款1類新藥上市可期;仿制藥方面,2017年以來公司有13個首仿(含劑型首仿)獲批,此外10個新分類報產(chǎn)品種在審,其中6個暫無首仿獲批。
拿下13個首仿、6款新藥,5個品種闖關(guān)新醫(yī)保
2022年國家醫(yī)保談判如箭在弦。從前段時間公布的通過初步審查名單來看,豪森藥業(yè)有5個目錄外品種在列,均為2017年1月1日至2022年6月30日期間,經(jīng)國家藥監(jiān)部門批準(zhǔn)上市的新通用名藥品。
米內(nèi)網(wǎng)數(shù)據(jù)顯示,2017年至今,豪森藥業(yè)有30余個品種獲批上市,其中6款為新藥(4款1類新藥、1款進口新藥及1款改良型新藥)。目前公司已有7款新藥(5款1類新藥)獲批上市,得益于創(chuàng)新藥接連獲批并實現(xiàn)商業(yè)化,豪森藥業(yè)創(chuàng)新藥收入由2020H1的7.5億元增長至2022H1的23.2億元,創(chuàng)新藥收入占總營收比重由2020H1的18.9%提升至2022H1的52.3%。
此外,13個為首仿(含劑型首仿),涵蓋8個治療大類,其中5個為消化系統(tǒng)及代謝藥,3個為抗腫瘤和免疫調(diào)節(jié)劑。目前公司還有10個新分類報產(chǎn)品種在審,其中6個暫無首仿獲批。
2017年至今豪森藥業(yè)獲批上市的新藥及首仿
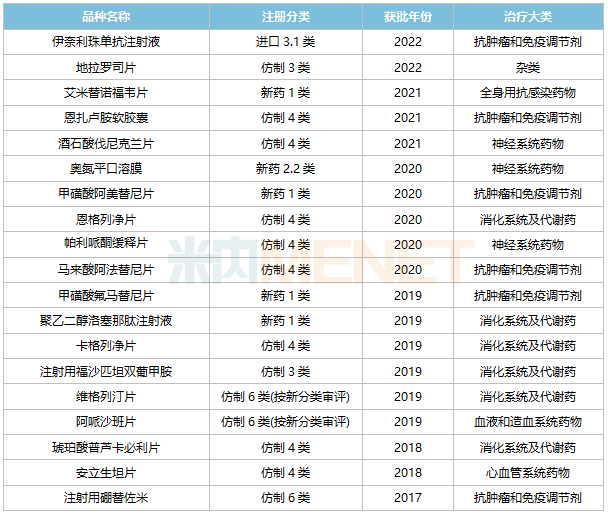
來源:米內(nèi)網(wǎng)中國申報進度(MED)數(shù)據(jù)庫
豪森藥業(yè)已上市的6款獨家創(chuàng)新藥中,5款已通過談判納入全國醫(yī)保目錄,其中甲磺酸阿美替尼片新適應(yīng)癥有望參與2022醫(yī)保談判;2022年獲批上市的伊奈利珠單抗注射液(國內(nèi)首款抗CD19單抗)已通過形式審查,有望通過談判納入2022醫(yī)保。
近三年達成10余項合作,引進多款差異化新藥
11月14日,豪森藥業(yè)公告稱,公司與普米斯簽訂許可協(xié)議,將獲得PM1080在大中華區(qū)(包括中國大陸、香港、澳門和臺灣地區(qū))的開發(fā)和商業(yè)化獨家權(quán)利,并向普米斯支付5000萬元的首付款及高達14.18億元的開發(fā)、注冊及基于銷售的商業(yè)化里程碑潛在付款,以及基于凈銷售額的分級特許權(quán)使用費。
PM1080是一款EGFR/c-Met雙特異性抗體藥物,具有能夠同時阻斷EGFR和c-Met的信號傳導(dǎo),抑制腫瘤生長和存活等作用的巨大治療潛力。目前國內(nèi)尚無EGFR/c-Met雙抗獲批上市,PM1080處于臨床前研究階段。
近年來,豪森藥業(yè)不斷加碼外部合作來擴寬產(chǎn)品管線,2020年至今達成10余項BD交易,合作企業(yè)包括普米斯、NiKang、TiumBio、GHDDI、Terns、Scynexis、Silence、志道生物、望石智慧等,其中與Silence的交易總額最高超13億美元。
2020年至今豪森藥業(yè)部分引進項目
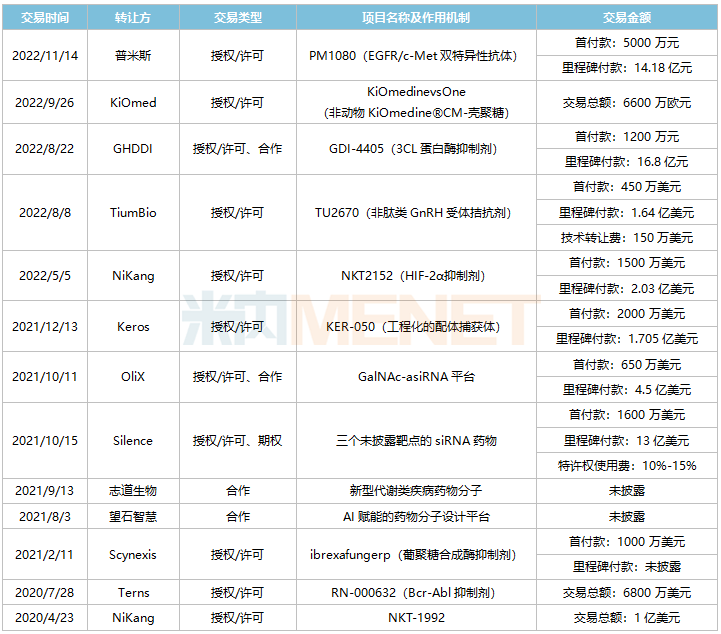
來源:公司公告,米內(nèi)網(wǎng)整理
從豪森藥業(yè)近年來引進的項目來看,主要分為三大類型:一是臨床后期的成熟創(chuàng)新產(chǎn)品,如抗真菌新藥ibrexafungerp,2021年在美國獲批上市,目前在國內(nèi)處于III期臨床;二是引進早期產(chǎn)品,豐富管線儲備,如引進自Silence的三個siRNA藥物;三是引進全球先進的技術(shù)平臺,如AI賦能的藥物分子設(shè)計平臺、GalNAc-asiRNA平臺等。
從引進的新藥研發(fā)進展看,ibrexafungerp(葡聚糖合成酶抑制劑)外陰陰道念珠菌病適應(yīng)癥已在國內(nèi)開展III期臨床;RN-000632(Bcr-Abl抑制劑)慢性髓性白血病適應(yīng)癥在國內(nèi)開展I期臨床;KER-050、NKT2152、TU2670全球最高研發(fā)進展均步入II期臨床,國內(nèi)暫未申報臨床。
33款新藥在路上,第6款1類新藥上市在即
除了積極探索可能的BD合作,豪森藥業(yè)也在不斷加碼自主研發(fā)。半年業(yè)績報告顯示,2022H1公司研發(fā)開支7.39億元,同比增長7.6%,占營收比重16.7%(2021年同期為15.6%)。
2020-2022年同期豪森藥業(yè)研發(fā)開支情況(單位:萬元)
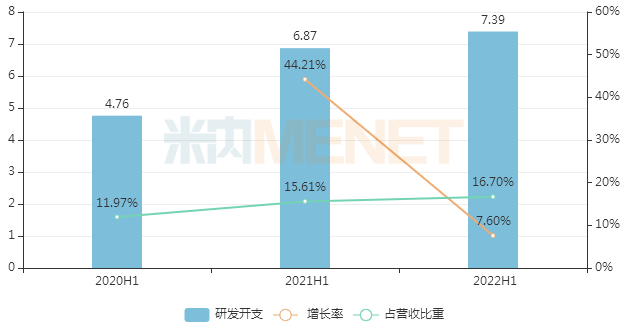
來源:公司公告
米內(nèi)網(wǎng)數(shù)據(jù)顯示,目前豪森藥業(yè)有33款創(chuàng)新藥處于申報臨床及以上階段(不含已上市新藥申報新適應(yīng)癥),涵蓋抗腫瘤、神經(jīng)系統(tǒng)、抗感染、消化道、心血管等治療領(lǐng)域,其中29款為1類新藥。
豪森藥業(yè)國內(nèi)在研新藥
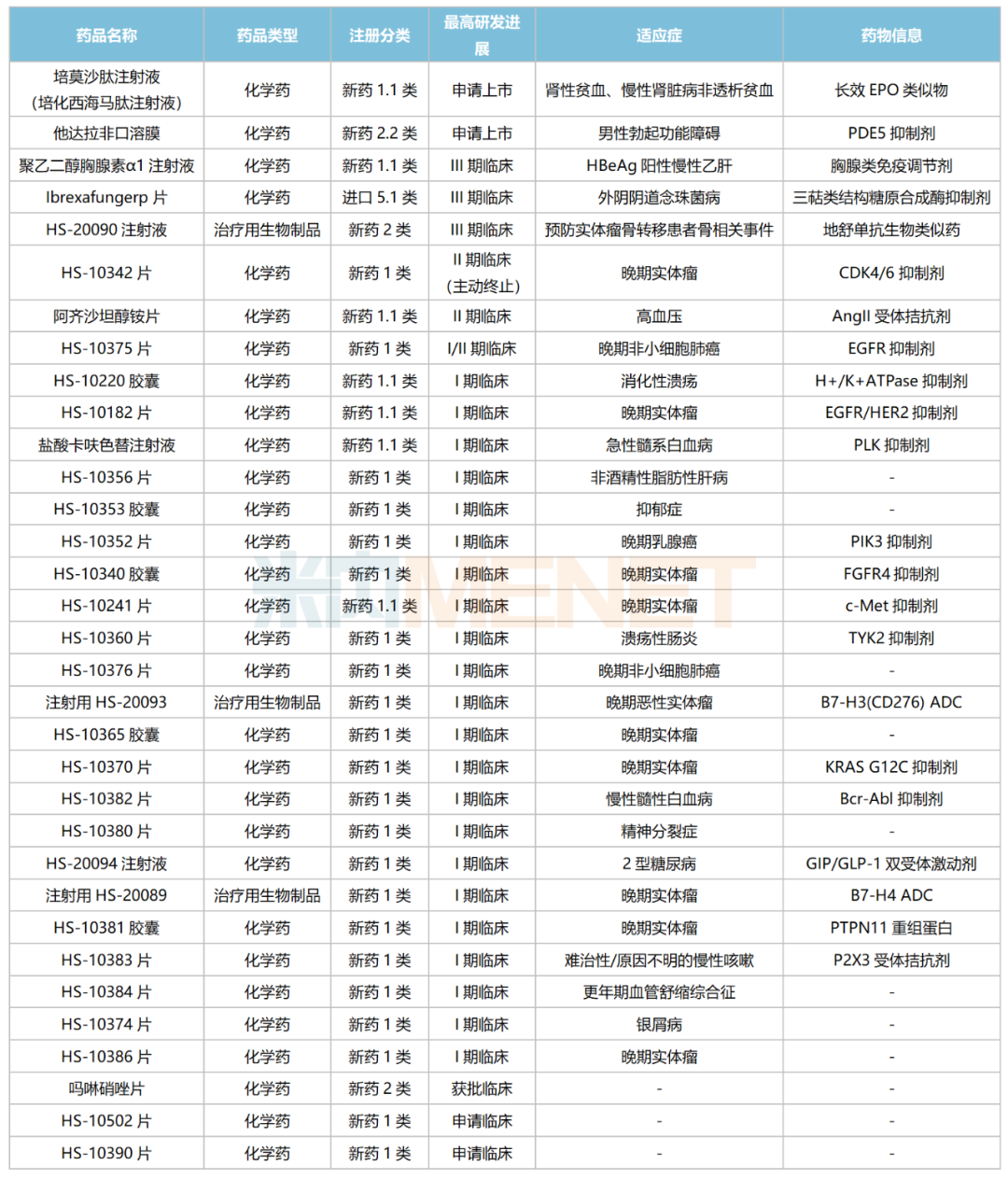
來源:米內(nèi)網(wǎng)中國臨床試驗庫、CDE官網(wǎng)
29款1類新藥中有27款為化學(xué)藥,涉及CDK4/6、EGFR、PIK3、c-Met等熱門靶點。
第6款1類新藥——培莫沙肽注射液有望于年內(nèi)獲批上市,目前國內(nèi)已上市EPO藥物以短效為主,尚無國產(chǎn)長效EPO藥物獲批。米內(nèi)網(wǎng)數(shù)據(jù)顯示,2021年中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構(gòu))終端人促紅素/重組人促紅素銷售規(guī)模超過35億元。
豪森藥業(yè)布局的生物藥1類新藥不多,但集中在ADC高潛力賽道,靶向B7-H3(CD276)的ADC藥物HS-20093、靶向B7-H4的ADC藥物HS-20089均在開展實體瘤適應(yīng)癥的I期臨床。
非1類新藥緊盯高端制劑及生物類似藥。他達拉非口溶膜為公司報產(chǎn)的第2款口溶膜,首款口溶膜——奧氮平口溶膜已于2020年獲批;HS-20090注射液為地舒單抗生物類似藥,目前正在開展III期臨床,安進的地舒單抗2021年全球銷售額超過50億美元。
資料來源:米內(nèi)網(wǎng)數(shù)據(jù)庫、公司公告等
注:米內(nèi)網(wǎng)《中國公立醫(yī)療機構(gòu)藥品終端競爭格局》,統(tǒng)計范圍是:中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院,不含民營醫(yī)院、私人診所、村衛(wèi)生室;上述銷售額以產(chǎn)品在終端的平均零售價計算。數(shù)據(jù)統(tǒng)計截至11月18日,如有疏漏,歡迎指正!

