12月28日訊 12月25日,上海陽光醫(yī)藥采購網(wǎng)發(fā)布《關(guān)于開展第四批國家組織藥品集中采購相關(guān)藥品信息收集工作的通知》,第四批國家集采信息申報(bào)工作正式開啟。
以下為通知全文:
各藥品相關(guān)企業(yè):
為進(jìn)一步做好第四批國家組織藥品集中采購工作,優(yōu)化工作流程,建立常態(tài)化工作機(jī)制,自2020年12月25日起,聯(lián)合采購辦公室開展第四批國家組織藥品集中采購相關(guān)信息申報(bào)工作,現(xiàn)將有關(guān)事項(xiàng)通知如下:
一、藥品要求
屬于藥品申報(bào)范圍(詳見附件)并獲得國內(nèi)有效注冊批件的上市藥品,且滿足以下要求之一:
1.原研藥及國家藥品監(jiān)督管理局發(fā)布的仿制藥質(zhì)量和療效一致性評價(jià)參比制劑。
2.通過國家藥品監(jiān)督管理局仿制藥質(zhì)量和療效一致性評價(jià)的仿制藥品。
3.根據(jù)《國家食品藥品監(jiān)督管理總局關(guān)于發(fā)布化學(xué)藥品注冊分類改革工作方案的公告》〔2016年第51號〕,按化學(xué)藥品新注冊分類批準(zhǔn)的仿制藥品。
4.納入《中國上市藥品目錄集》的藥品。
二、企業(yè)要求
屬于本次藥品申報(bào)范圍并滿足藥品要求的相關(guān)企業(yè),包括:提供藥品及伴隨服務(wù)的國內(nèi)藥品生產(chǎn)企業(yè),藥品上市許可持有人,境外生產(chǎn)企業(yè)在中國大陸設(shè)立或指定并能承擔(dān)相應(yīng)法律責(zé)任的代表機(jī)構(gòu)或企業(yè)法人。
三、申報(bào)內(nèi)容
1.生產(chǎn)企業(yè)、藥品上市許可持有人、境外生產(chǎn)企業(yè)在中國大陸設(shè)立或指定并能承擔(dān)相應(yīng)法律責(zé)任的代表機(jī)構(gòu)或企業(yè)法人(包括企業(yè)名稱、統(tǒng)一社會信用代碼、聯(lián)系人、授權(quán)書等)。
2.符合藥品要求的證明材料(包括藥品注冊批件、補(bǔ)充注冊批件、說明書等)。
3.產(chǎn)能及原料藥自產(chǎn)說明等。
四、注意事項(xiàng)
1.填報(bào)方式:請登陸“國家組織藥品集中采購綜合服務(wù)平臺”(網(wǎng)址:http://pub.smpaa.cn/xxsj)進(jìn)行企業(yè)注冊及信息填報(bào)。新用戶需選擇“資質(zhì)維護(hù)用戶”身份進(jìn)行注冊;已有“資質(zhì)維護(hù)用戶”賬號的用戶,賬號長期有效不可重復(fù)注冊。
2.審核通過的藥品信息經(jīng)企業(yè)確認(rèn)將生成《申報(bào)信息一覽表》,作為第四批國家組織藥品集中采購的申報(bào)依據(jù),請正確填寫相關(guān)信息。具體要求以采購文件規(guī)定為準(zhǔn)。
3.聯(lián)系方式:021-31773244、31773255、31773266
(服務(wù)時(shí)間8:30-11:30, 13:30-16:30;節(jié)假日除外)
特此通知。
聯(lián)合采購辦公室
2020年12月25日
附:藥品申報(bào)范圍
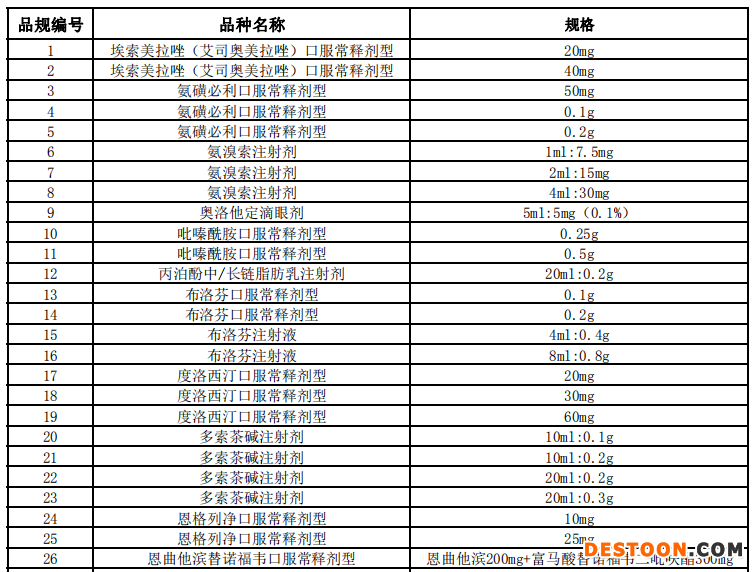
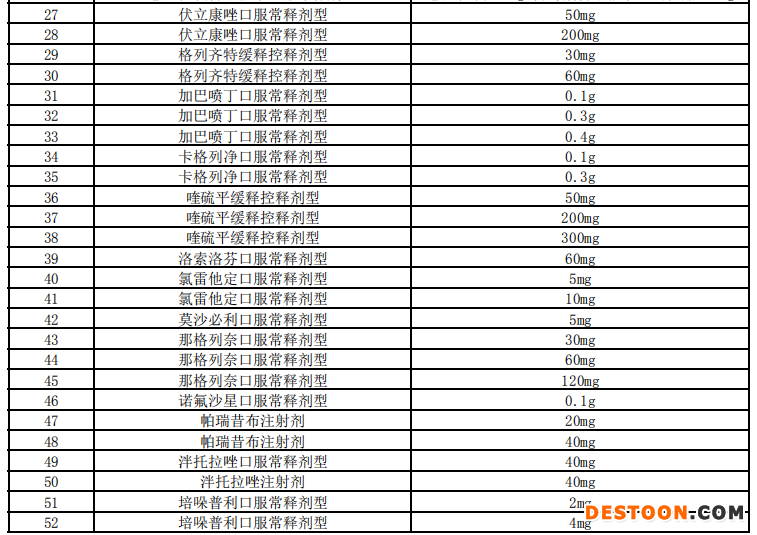
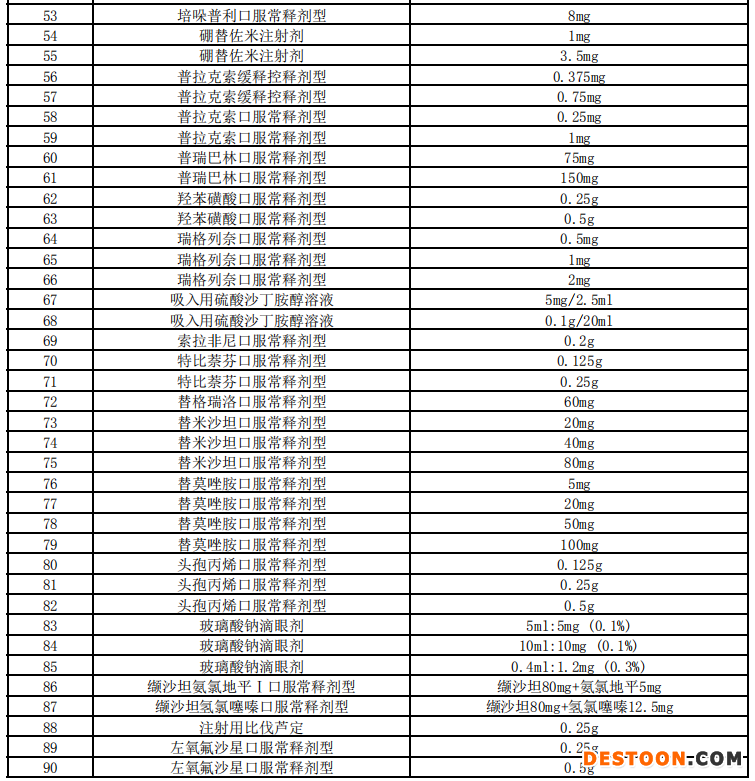



 110102000668(1)號
110102000668(1)號