2月28日是國際罕見病日,中國現(xiàn)有罕見病患者超2000萬人,每年新增超過20萬人。全球已確認(rèn)的罕見病超過7000種,并以每年250種至280種的速度遞增,世界人口基數(shù)龐大,罕見病其實(shí)并不“罕見”。近日,中國血友病患者呼吁羅氏艾美賽珠單抗降價(jià)引發(fā)熱議。目前國內(nèi)罕見病治療大部分依靠進(jìn)口藥品,據(jù)統(tǒng)計(jì),已有超40種罕見病藥物被納入醫(yī)保目錄,跨國藥企則扎堆涌現(xiàn),而國內(nèi)藥企則奮起直追,截至目前,國內(nèi)藥企開發(fā)的藥物獲得FDA授予孤兒藥資格認(rèn)定有100項(xiàng)左右,其中,不乏信達(dá)生物、恒瑞醫(yī)藥、復(fù)星醫(yī)藥、石藥集團(tuán)等國內(nèi)醫(yī)藥巨頭,北??党蓜t憑借“License-in”模式不斷壯大。
70萬“天價(jià)藥”降至3.3萬!超40種罕見病藥進(jìn)醫(yī)保
近日,一篇《中國血友病患者致羅氏制藥的一封公開信》引發(fā)熱議,信中指出,羅氏治療血友病A的罕見病藥物艾美賽珠單抗注射液上市以來價(jià)格一直居高不下,血友病患者呼吁羅氏降價(jià)。
據(jù)統(tǒng)計(jì),目前國內(nèi)共有60余種罕見病用藥獲批上市,其中已有40余種被納入國家醫(yī)保藥品目錄,涉及25種疾病。其中,多發(fā)性硬化、肺動(dòng)脈高壓、帕金森癥(青年型、早發(fā)型)、血友病4種罕見病納入醫(yī)保的藥物相對較多,均超過5種。
已納入醫(yī)保的罕見病藥物
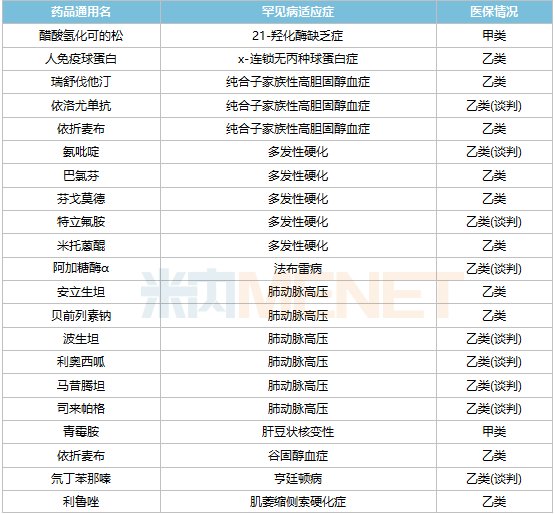
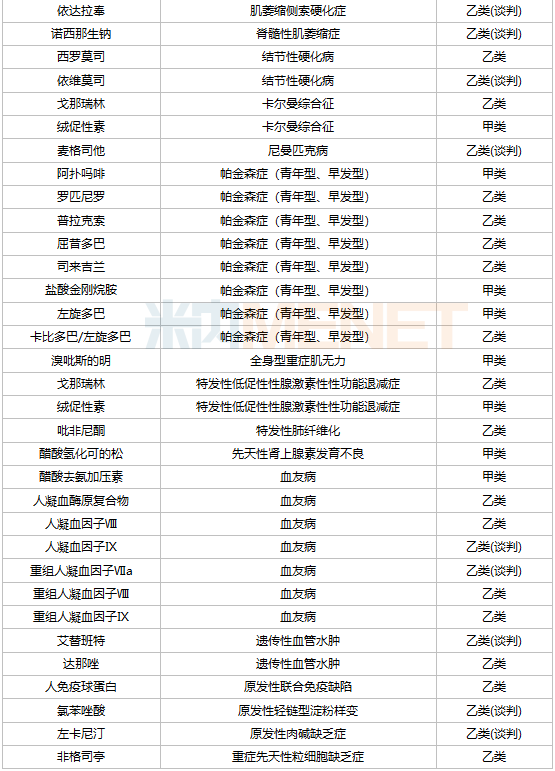
罕見病藥物進(jìn)入醫(yī)保目錄是降價(jià)的主要路徑之一,2021年通過醫(yī)保談判首次進(jìn)入醫(yī)保目錄的罕見病品種有7個(gè),包括依洛尤單抗注射液、諾西那生鈉注射液、人凝血因子Ⅸ、阿加糖酶α注射用濃溶液、氯苯唑酸軟膠囊、醋酸艾替班特注射液和氨吡啶緩釋片。其中,諾西那生鈉注射液是首個(gè)被納入國家醫(yī)保目錄的高值罕見病藥物,這款用于治療脊髓型肌萎縮癥的藥物價(jià)格一度高達(dá)70萬元/針,2021年以3.3萬元/針成功通過醫(yī)保談判,降價(jià)幅度高達(dá)95%。
超100億市場群雄逐鹿!國內(nèi)藥企奮起直追
數(shù)據(jù)顯示,2022年中國罕見病市場預(yù)計(jì)有24億美元(約152億元),2030年將增至259億美元(約1642億元),市場增速顯著,前景廣闊,隨著近年罕見病市場持續(xù)升溫,越來越多的企業(yè)瞄準(zhǔn)中國市場。
目前國內(nèi)罕見病藥物主要依靠進(jìn)口藥品,跨國藥企紛紛在此“攻城掠地”。2018年以來,已上市的罕見病藥物中,超過80%是進(jìn)口藥物。賽諾菲、羅氏、武田、渤健等都是國內(nèi)罕見病市場的老面孔,阿斯利康2020年底收購罕見病制藥公司Alexion后,也正式入局罕見病領(lǐng)域。同時(shí),跨國藥企在逐漸加大罕見病領(lǐng)域的業(yè)務(wù)比重。例如,輝瑞在去年末重調(diào)中國區(qū)組織架構(gòu),罕見病被納入為六大獨(dú)立事業(yè)部之一;阿斯利康2021年9月宣布正式成立中國罕見病業(yè)務(wù)部。
而國內(nèi)藥企則奮起直追,截至目前,國內(nèi)藥企開發(fā)的藥物獲得FDA授予孤兒藥資格認(rèn)定有100項(xiàng)左右,涉及超過50家藥企,其中,不乏信達(dá)生物、恒瑞醫(yī)藥、復(fù)星醫(yī)藥、石藥集團(tuán)等國內(nèi)醫(yī)藥巨頭,北??党蓜t憑借“License-in”模式不斷壯大。
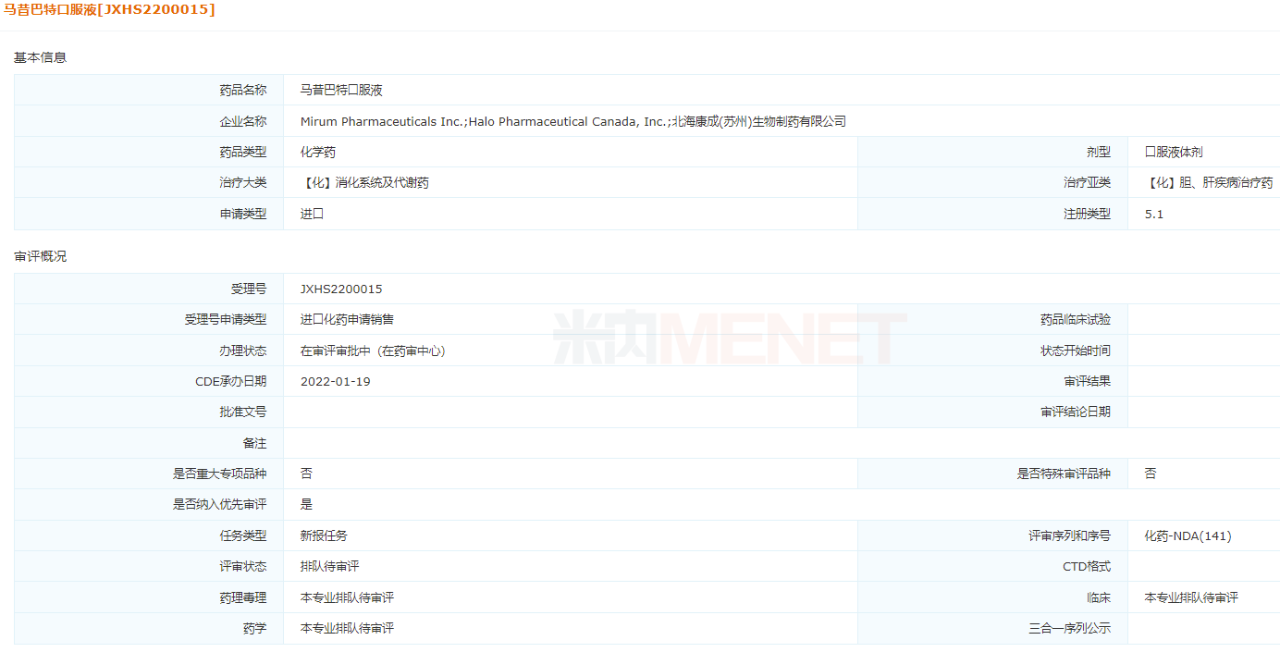
今年1月,北??党傻暮币姴∷幬锺R昔巴特口服液申報(bào)上市,因“符合兒童生理特征的兒童用藥品新品種、劑型和規(guī)格”擬納入優(yōu)先審評,用于1歲及以上Alagille綜合征(ALGS)患者膽汁淤積性瘙癢。馬昔巴特口服液于2021年9月在美國獲批上市,是全球首個(gè)也是唯一一個(gè)治療ALGS罕見病的藥物。2021年4月,北海康成和原研廠家Mirum達(dá)成合作,獲得在大中華區(qū)針對ALGS、進(jìn)行性家族性肝內(nèi)膽汁淤積和膽管閉鎖開發(fā)和商業(yè)化馬昔巴特的獨(dú)家授權(quán)。針對ALGS國內(nèi)尚未有該適應(yīng)癥的治療藥物上市,北海康成有望憑借馬昔巴特口服液占據(jù)該罕見病領(lǐng)域的領(lǐng)先位置。
值得一提的是,馬昔巴特口服液并不是北??党?ldquo;License-in”的唯一案例,相反,北海康成算得上是“License-in”模式的老兵。成立的10年間,北海康成有3款產(chǎn)品已獲批上市,均由國外引進(jìn)。預(yù)防和治療化療引起的口腔黏膜炎的康普舒,引進(jìn)自英國EUSA制藥公司;用于HER2陽性早期乳腺癌強(qiáng)化輔助治療的奈拉替尼引進(jìn)自美國Puma生物技術(shù)公司;以及中國首個(gè)黏多糖貯積癥Ⅱ型酶替代療法藥物海芮思(艾度硫酸酯酶β),引進(jìn)自韓國GC Pharma公司。
從在研品種來看,除了申報(bào)上市的馬昔巴特口服液,北海康成還有3個(gè)產(chǎn)品處于臨床階段,另外3個(gè)產(chǎn)品處于臨床前階段。其中,包括其核心產(chǎn)品是CAN008(Asunercept)。CAN008是一種正開發(fā)用于治療膠質(zhì)母細(xì)胞瘤(GBM)的CD95-Fc糖基化融合蛋白,目前在國內(nèi)處于II期臨床試驗(yàn)階段。據(jù)了解,CAN008是來自Apogenix公司,2015年6月由北??党梢M(jìn)中國。
罕見病領(lǐng)域本來因受眾范圍窄、收益不確定,前期研發(fā)更加困難,北??党衫?ldquo;License-in”路徑,與自身研發(fā)產(chǎn)品形成豐富的產(chǎn)品管線,彌補(bǔ)自身產(chǎn)品管線的短板。再者,成功地運(yùn)用這一模式,為企業(yè)帶來可觀的回報(bào)。2021年12月,北??党沙晒υ诟凵鲜?。
亞盛、石藥、百濟(jì)神州……揚(yáng)帆出海
在國外,罕見病藥物更常被稱為“孤兒藥”,為了激發(fā)企業(yè)對孤兒藥的研發(fā)動(dòng)力,30年前美國頒布的《孤兒藥法案》,獲得孤兒藥資格認(rèn)定藥物可享受臨床試驗(yàn)費(fèi)用稅收減免、免除NDA申請費(fèi)用、獲得研發(fā)資助、美國市場7年獨(dú)占權(quán)等紅利,至今有效。對國內(nèi)藥企而言,藥物在FDA獲得孤兒藥的資格認(rèn)定是對自身研發(fā)實(shí)力的認(rèn)可,通過中美雙報(bào)紅利,藥物更能搶占國內(nèi)市場先機(jī)。更重要的是,孤兒藥資格認(rèn)定可以成為新藥進(jìn)入美國市場的敲門磚,是中國創(chuàng)新藥走向國際化的一條捷徑。
2月14日,信達(dá)生物與馴鹿醫(yī)療聯(lián)合開發(fā)的靶向B細(xì)胞成熟抗原(BCMA)嵌合抗原受體自體T細(xì)胞(CAR-T)的創(chuàng)新藥IBI326,獲得美國FDA授予的孤兒藥資格認(rèn)定,主要用于治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤,這是信達(dá)生物第2個(gè)獲得FDA授予孤兒藥資格認(rèn)定的藥物。
獲FDA孤兒藥資格認(rèn)定TOP3企業(yè)情況
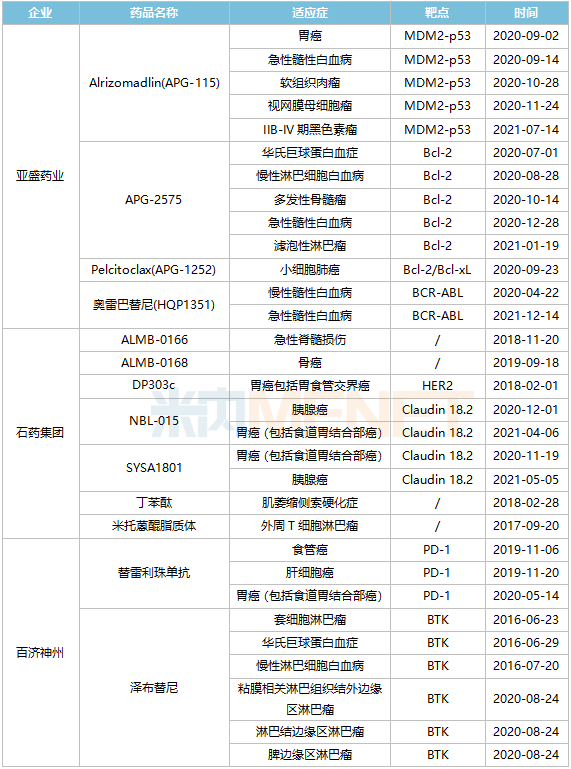
從獲FDA孤兒藥資格認(rèn)定數(shù)量來看,亞盛藥業(yè)、石藥集團(tuán)、百濟(jì)神州走在前列。亞盛藥業(yè)共有4個(gè)在研藥物獲得共計(jì)13項(xiàng)美國FDA授予的孤兒藥資格認(rèn)定,持續(xù)刷新中國藥企的記錄,成為中國的孤兒藥管線龍頭;石藥集團(tuán)擁有7個(gè)在研藥物共9項(xiàng)孤兒藥資格認(rèn)定;百濟(jì)神州憑借替雷利珠單抗和澤布替尼2個(gè)藥物也拿下9項(xiàng)孤兒藥資格認(rèn)定。
亞盛藥業(yè)第三代BCR-ABL抑制劑奧雷巴替尼在2021年11月獲NMPA批準(zhǔn)上市,用于治療任何酪氨酸激酶抑制劑(TKI)耐藥,并采用經(jīng)充分驗(yàn)證的檢測方法診斷為伴有T315I突變的慢性髓細(xì)胞白血?。–ML)慢性期(CP)或加速期(AP)的成年患者。目前,奧雷巴替尼在美國已獲得2項(xiàng)孤兒藥資格,用于治療慢性髓性白血病和用于治療急性髓性白血病。第一代BCR-ABL抑制劑格列衛(wèi)(伊馬替尼)是奧雷巴替尼商業(yè)價(jià)值重要參考物,米內(nèi)網(wǎng)數(shù)據(jù)顯示,2020年中國城市公立醫(yī)院、縣級(jí)公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機(jī)構(gòu))終端伊馬替尼銷售額超過20億元。
石藥集團(tuán)的米托蒽醌脂質(zhì)體在2022年1月在國內(nèi)獲批上市,用于治療復(fù)發(fā)或難治的外周T細(xì)胞淋巴瘤(PTCL)。而在美國,米托蒽醌脂質(zhì)體也獲得治療外周T細(xì)胞淋巴瘤的孤兒藥資格認(rèn)定。另外,石藥集團(tuán)的丁苯酞軟膠囊2005年在國內(nèi)上市,2020年在中國公立醫(yī)療機(jī)構(gòu)終端丁苯酞銷售額突破60億元大關(guān),2017年丁苯酞獲得治療肌萎縮側(cè)索硬化癥孤兒藥認(rèn)定資格,石藥集團(tuán)將這個(gè)中國1類新藥推向國際市場。
百濟(jì)神州的替雷利珠單抗和澤布替尼都是已在國內(nèi)獲批的重磅藥物。替雷利珠單抗是國內(nèi)第6款上市的PD-1藥物,目前替雷利珠單抗已獲得食管癌、肝細(xì)胞癌、胃癌(包括食道胃結(jié)合部癌)3個(gè)孤兒藥資格認(rèn)定。澤布替尼更是第一個(gè)在美國獲批上市的國產(chǎn)抗癌藥,創(chuàng)造歷史。2022年2月23日,澤布替尼新適應(yīng)癥上市申請已獲美國FDA受理。目前,澤布替尼獲得了6項(xiàng)孤兒藥資格認(rèn)定,是目前國內(nèi)藥企獲得孤兒藥資格認(rèn)定最多的藥物。



