近段時間,上市公司陸續(xù)發(fā)布中期業(yè)績報告,據(jù)不完全統(tǒng)計,278家A股及港股上市藥企披露2020年H1研發(fā)投入情況,合計金額超過350億元。120家藥企研發(fā)投入超過5000萬元,其中有5家藥企超10億(去年同期為4家);疫情影響下,仍有近8成藥企研發(fā)投入呈正增長,東陽光藥暴漲500%;42家藥企研發(fā)投入占營業(yè)收入比重達(dá)10%及以上,5家超過100%。
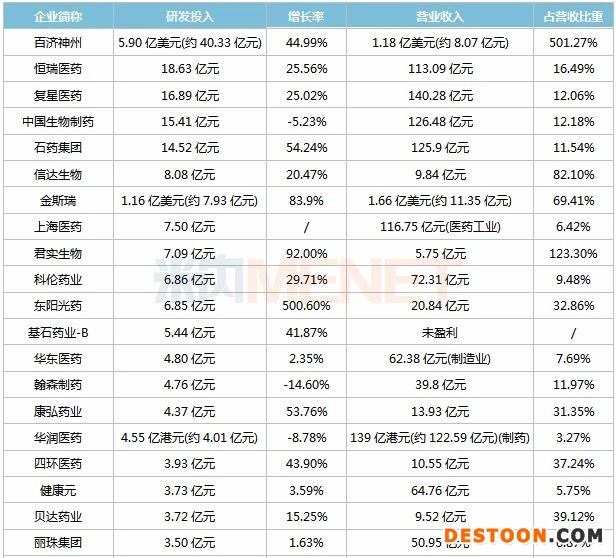
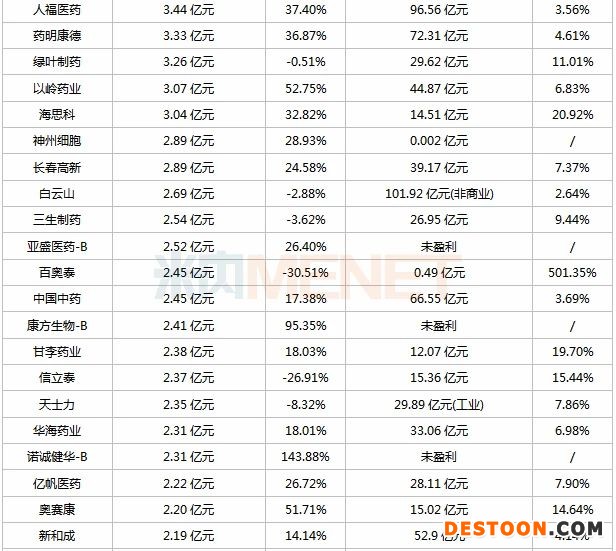
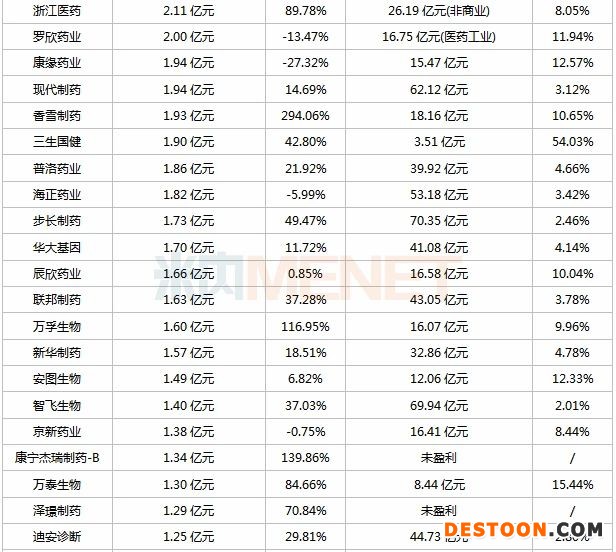
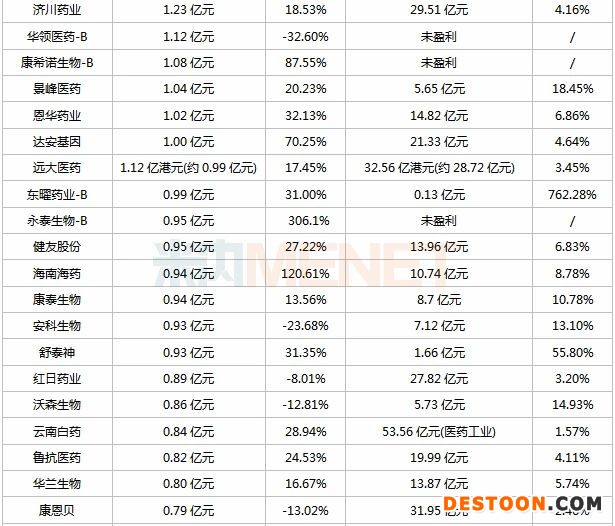
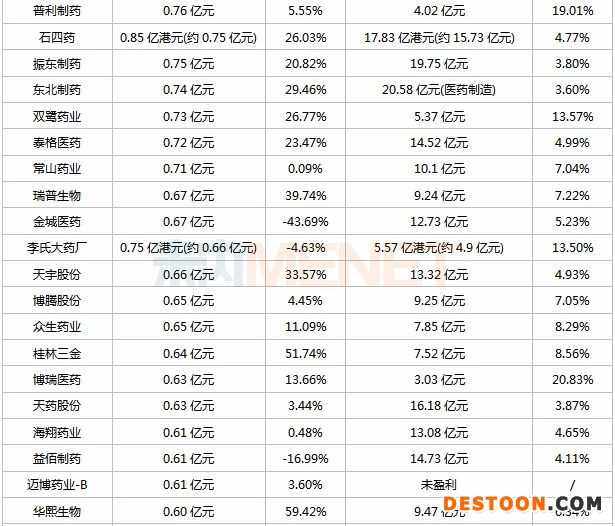
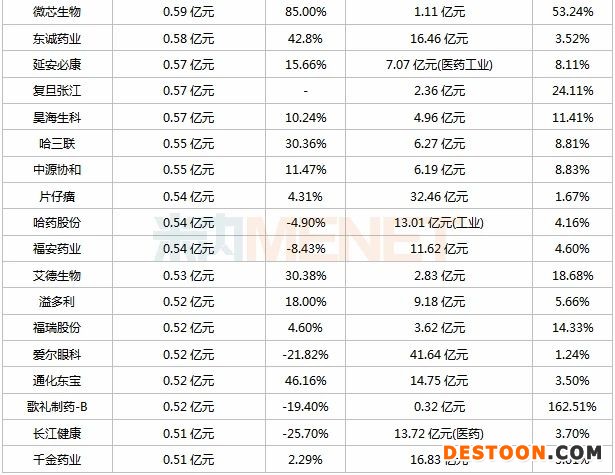
表:2020年上半年研發(fā)投入超過5000萬的上市藥企






注:表格為不完全統(tǒng)計;匯率以9月8日計
68家藥企半年研發(fā)投入過億,恒瑞、復(fù)星......5家超10億
120家藥企上半年研發(fā)投入超過5000萬元,合計金額超過300億元,其中68家藥企研發(fā)投入超過1億元(去年同期為52家),百濟(jì)神州、中國生物制藥、恒瑞醫(yī)藥、復(fù)星醫(yī)藥、石藥集團(tuán)位列TOP5,研發(fā)投入均超過10億元,且研發(fā)投入占營收比例均超過10%。
百濟(jì)神州研發(fā)開支5.9億美元(約40億元),較去年同期增長44.99%,占營業(yè)收入比重501.27%。截至報告期末,全球臨床開發(fā)團(tuán)隊超過1350人,進(jìn)行或計劃中的臨床試驗70項。自主研發(fā)的1類新藥中,替雷利珠單抗注射液(PD-1)、澤布替尼膠囊(BTK抑制劑)已獲批上市,帕米帕利膠囊(PARP1及PARP2抑制劑)已申報上市,BGB-283膠囊(RAF抑制劑)完成I期臨床,BGB-3245-MBP膠囊、BGB-A333注射液等獲批臨床。
恒瑞醫(yī)藥研發(fā)投入18.63億元,較去年同期增長25.56%,占營業(yè)收入比重16.49%。報告期內(nèi),公司獲得創(chuàng)新藥生產(chǎn)批件3個、仿制藥生產(chǎn)批件1個、創(chuàng)新藥臨床批件37個;3個品種通過一致性評價,2個產(chǎn)品申報一致性評價;向FDA遞交3個原料藥、1個中間體、2個制劑的注冊申請。目前公司擁有3400多人的研發(fā)團(tuán)隊,創(chuàng)新藥艾瑞昔布、阿帕替尼、硫培非格司亭、吡咯替尼、卡瑞利珠單抗、甲苯磺酸瑞馬唑侖已獲批上市,未來基本形成每年均有創(chuàng)新藥申請臨床,每1-2年有創(chuàng)新藥上市的良性發(fā)展態(tài)勢。
復(fù)星醫(yī)藥研發(fā)投入16.89億元,較去年同期增長25.02%,占營業(yè)收入比重12.06%。報告期內(nèi),公司引進(jìn)的創(chuàng)新藥阿伐曲泊帕片獲批上市,F(xiàn)KC876(CAR-T產(chǎn)品)申報上市,12個仿制藥獲得FDA批準(zhǔn)上市。截至報告期末,公司研發(fā)人員近2300人,在研創(chuàng)新藥、仿制藥、生物類似藥及一致性評價等項目共248項,其中小分子創(chuàng)新藥17項、改良型新藥2項、生物創(chuàng)新藥21項、生物類似藥21項、仿制藥117項、一致性評價項目46項、中藥2項;6個項目正在申報臨床試驗、33個項目正在進(jìn)行臨床試驗、34個項目等待審批上市,23個產(chǎn)品通過一致性評價;累計引進(jìn)項目22項,其中進(jìn)口創(chuàng)新藥9項,進(jìn)口仿制藥13項。
中國生物制藥研發(fā)開支15.41億元,較去年同期下滑5.23%,占營業(yè)收入比重12.18%。報告期內(nèi),公司獲得生產(chǎn)批件12件、臨床批件22件、過評(含視同過評)品種9個;申報生產(chǎn)19件、申報臨床29件、新申報一致性評價4件。截至目前,公司累計臨床批件、正在進(jìn)行臨床試驗和申報生產(chǎn)的在研產(chǎn)品共438件,其中肝病用藥38件、抗腫瘤用藥189件、呼吸系統(tǒng)用藥22件、內(nèi)分泌用藥24件、心腦血管用藥35件及其他類用藥130件。
石藥集團(tuán)研發(fā)費(fèi)用14.52億元,較去年同期增長54.24%,占營業(yè)收入比重11.54%。報告期內(nèi),公司取得藥品注冊批件9個,臨床批件5個,12個品種(18個品規(guī))通過一致性評價,1個仿制藥獲得FDA批準(zhǔn)上市,1個制劑改良型新藥申請上市。截至報告期末,公司研發(fā)團(tuán)隊超過2000人,在研項目300余項,其中小分子創(chuàng)新藥40余項、大分子創(chuàng)新藥50余項,新型制劑20余項;目前有25個藥品處于注冊審評待批階段,42個產(chǎn)品正在開展臨床試驗(31個創(chuàng)新藥、11個新型制劑),9個產(chǎn)品正在進(jìn)行生物等效性試驗,7個產(chǎn)品待批臨床批件(6個國內(nèi)、1個美國)。
近8成藥企加大研發(fā)投入,這7家同比增長超100%
2020年爆發(fā)的新冠肺炎疫情影響所有行業(yè)經(jīng)濟(jì)增長,醫(yī)藥行業(yè)也難以幸免,但仍有大部分的藥企持續(xù)加大研發(fā)投入。2020年上半年研發(fā)投入5000萬元的120家藥企中,有94家藥企研發(fā)投入較去年同期呈正增長,占比近80%。
研發(fā)投入同比增長超過100%的企業(yè)共有7家,包括東陽光藥(500.60%)、永泰生物-B(306.1%)、香雪制藥(294.06%)、諾誠健華-B(143.88%)、康寧杰瑞制藥-B(139.86%)、海南海藥(120.61%)、萬孚生物(116.95%)。
東陽光藥研發(fā)投入6.85億元,較去年同期增長500.6%,占營業(yè)收入比重32.86%。報告期內(nèi),公司首個生物制品重組人胰島素注射液獲批上市,3個仿制藥獲批生產(chǎn),預(yù)計將在本年度獲得另外10-12個品種的上市批件;啟動磷酸奧司他韋顆粒一致性評價,預(yù)計2021年過評。截至報告期末,1類新藥磷酸依米他韋(NS5A抑制劑)申報上市,預(yù)計2020年下半年獲批;伏拉瑞韋(NS3/4A蛋白酶抑制劑)啟動III期臨床,預(yù)計2021年申報上市。米內(nèi)網(wǎng)數(shù)據(jù)顯示,目前東陽光藥在研新藥(不含原料藥及已上市品種)超過30個,其中1類新藥超過20個。
香雪制藥研發(fā)投入1.93億元,較去年同期增長294.06%,占營業(yè)收入比重10.65%。公司主營業(yè)務(wù)為現(xiàn)代中藥及中藥飲片的研發(fā)、生產(chǎn)和銷售,近幾年來逐漸涉足化藥的研發(fā)。截至報告期末,公司1類新藥KX02片、TAEST16001注射液正在開展I期臨床,STP705正在開展I期臨床的準(zhǔn)備工作。
諾誠健華-B研發(fā)成本2.31億元,較去年同期增長143.88%,暫未有產(chǎn)品實現(xiàn)商業(yè)化。報告期內(nèi),首個1類新藥奧布替尼(BTK抑制劑)提交兩項新藥上市申請(復(fù)發(fā)難治CLL/SLL及MCL)。截至報告期末,公司擁有雇員287名,其中173名為研究及開發(fā)人員;在研1類新藥中,ICP-192(pan-FGFR抑制劑)在進(jìn)行II期臨床,ICP-105(FGFR4抑制劑)在進(jìn)行I期臨床,ICP-723(TRK抑制劑)獲批臨床,ICP-332(TYK2抑制劑)、ICP-189(SHP2變構(gòu)抑制劑)、ICP-490等處于IND準(zhǔn)備階段。
42家藥企研發(fā)占營收比重達(dá)10%及以上,這5家超過100%
120家藥企中有10家暫未有產(chǎn)品實現(xiàn)商業(yè)化,42家藥企研發(fā)投入占營業(yè)收入比重超過10%,東曜藥業(yè)-B(762.28%)、百奧泰(501.35%)、百濟(jì)神州(501.27%)、歌禮制藥-B(162.51%)、君實生物(123.30%)5家藥企突破100%。
百奧泰研發(fā)費(fèi)用2.45億元,較去年同期減少30.51%,占營收比重501.35%。截至報告期末,公司研發(fā)團(tuán)隊共計249人,1個產(chǎn)品獲批生產(chǎn)(BAT1406),為國內(nèi)首款阿達(dá)木單抗生物類似藥,2020年上半年實現(xiàn)銷售收入0.49億元;23個產(chǎn)品在研,2個已提交上市申請(創(chuàng)新藥BAT2094、生物類似藥BAT1706),3個處于III期臨床階段(BAT1806、BAT2506、BAT8001)。
君實生物研發(fā)開支7.09億元,較去年同期增長92.00%,占營收比重123.30%。報告期內(nèi),JS001(特瑞普利單抗)正在進(jìn)行15項關(guān)鍵注冊臨床試驗(2項已遞交NDA申請),國內(nèi)首個新型冠狀病毒中和抗體JS016(重組全人源抗SARS-CoV-2單抗注射液)進(jìn)入I期臨床,TAB004/JS004(BTLA單抗)獲批臨床。截至報告期末,公司在研產(chǎn)品21個(19個創(chuàng)新藥、2個生物類似藥),覆蓋惡性腫瘤、自身免疫性疾病、慢性代謝類疾病、神經(jīng)系統(tǒng)疾病及感染類疾病,其中UBP1213(阿達(dá)木單抗生物類似藥)已申請上市。
來源:東方財富網(wǎng)、上市公司年報
注:數(shù)據(jù)統(tǒng)計截至9月8日,純手工整理,如有疏漏,歡迎指正!



 110102000668(1)號
110102000668(1)號